~新たな治療法の開発へ期待~
近畿大学医学部(大阪府大阪狭山市)内科学教室(消化器内科部門)准教授 渡邉智裕らの研究グループは、膵臓の慢性疾患の一つである自己免疫性膵炎の発症について、腸内で一定のバランスを保ちながら共存する細菌の集まりである腸内細菌叢(腸内フローラ)の変化に対する免疫反応が深く関わっていることを世界で初めて明らかにした。これにより、自己免疫性膵炎の新たな治療法の開発や発症の予防法の確立が期待される。
本件に関する論文が、令和元年(2019年)7月10日(水)午前0:00(日本時間)、免疫学分野の専門誌である“International Immunology”にオンライン掲載された。
1. 本件のポイント
●自己免疫性膵炎の発症メカニズムに腸内細菌叢が影響していることを明らかにした
●腸内細菌叢を変化させることで、自己免疫性膵炎の発症が抑制されるメカニズムを解明
●自己免疫性膵炎の新たな治療法の開発へさらなる発展
2. 本件の内容
膵臓の慢性炎症性疾患は「自己免疫性膵炎」と「慢性膵炎」の2つに大別される。指定難病である自己免疫性膵炎は、自己の膵臓組織を免疫システムが誤って攻撃することで、全身性の炎症性疾患の症状として発症する。また、膵癌を始めとする各種の癌が合併し、病気が進行すると二次性の糖尿病が起こることがある。
本疾患は高齢者の男性に多いと言われているが、その発症メカニズムの詳細については明らかになっていなかった。自己免疫性膵炎に対しては現在、ステロイドによる免疫抑制療法が行われているが、ステロイドにはさまざまな副作用があり、新たな治療法の開発が期待されている。渡邉らの研究チームは平成20年(2008年)より、「自己免疫性膵炎」と「慢性膵炎」について研究を続けてきた。
本研究では、自己免疫性膵炎において、腸内細菌叢の変化に伴い腸管の免疫機構が変化することに着目し、それが膵臓における自己免疫性膵炎の発症にどう影響するかをテーマにした実験を行った。マウスを用いて人為的に腸内細菌叢を変化させたところ、免疫細胞の一種である形質細胞様樹状細胞※1が膵臓で増加していることがわかった。
この結果、自己免疫性膵炎の発症に腸内細菌に対する免疫反応が大きく関わっていることが示唆された。本研究成果により、自己免疫性膵炎発症のメカニズムに腸内細菌に対する免疫反応が関与していることが判明しただけでなく、新たな治療法の開発や発症の予防にも結びつくことが期待されている。
3. 論文掲載
・論文名:Intestinal dysbiosis mediates experimental autoimmune pancreatitis viaactivation of plasmacytoid dendritic cells
・掲載誌:InternationalImmunology(IF:5.189)
・共筆頭著者:鎌田 研、 渡邉 智裕*、三長 孝輔、原 茜、吉川 智恵、岡本 彩那、山雄 健太郎、竹中 完、工藤 正俊 近畿大学医学部内科学教室(消化器内科部門)、朴 雅美 近畿大学医学部微生物学教室 *責任著者
渡邉らの研究グループは平成20年(2008年)より自己免疫性膵炎と慢性膵炎の発症メカニズムの解明に取り組んでおり、研究成果の総説論文はTrend in Immunologyに掲載されています。
https://www.cell.com/trends/immunology/fulltext/S1471-4906(18)30170-4
今回の論文では、これまでの研究をさらに発展させ、自己免疫性膵炎に特化した研究成果を紹介しています。
4. 研究詳細
ヒトの腸管には約100兆個の細菌が固有のバランスを保ちながら常在していると言われており、腸内細菌叢と呼ばれている。近年、腸内細菌叢が腸管における免疫反応を制御することにより、腸管だけではなく、さまざまな全身性疾患の発症に関わることが明らかになってきた。
渡邉らのグループは自己免疫性膵炎の発症には「I型インターフェロン」※2と「インターロイキン33」※3を産生する形質細胞様樹状細胞が病的な役割を果たすことを報告してきた(Trends in Immunology 018;39:874-889, Journal of Immunology 2017;198:3886-3896, Journal of Immunology 2015;195:3033-3044)。
しかしながら、「形質細胞様樹状細胞がどのような刺激を受けて、I型インターフェロンとインターロイキン33を産生するのか?」そのメカニズムは明らかになっていない。
そこで、研究グループは「腸内細菌叢の変化が形質細胞様樹状細胞を活性化し、病気を引き起こすのではないか?」と想定し研究を進めた。最初の実験として、自己免疫性膵炎モデルのマウスに対して抗生剤を投与することで腸内細菌を死滅させ、劇的に腸内細菌叢を変化させたところ、膵臓に存在する形質細胞様樹状細胞が減少し、自己免疫性膵炎の発症が明らかに抑制されることが分かった。
次世代シークエンサーを用いて、腸内細菌叢の変化を検討したところ、自己免疫性膵炎を発症したマウスでは正常なマウスと比べ、腸内細菌の多様性が失われていることも明らかになった。これらのことから、自己免疫性膵炎の発症に腸内細菌叢の変化が関与することが示された。
さらに研究を進めていく過程で、自己免疫性膵炎を発症したマウスの腸内細菌の移行によって、本来ならば自己免疫性膵炎を発症しない条件でも膵炎が発症することが判明した。さらに、自己免疫性膵炎を発症したマウスの糞便を移植することが、自己免疫性膵炎の発症を促進することもわかった。
興味深いことに、腸内細菌叢の変化に伴い、「I型インターフェロン」と「インターロイキン33」を産生する形質細胞様樹状細胞が膵臓で著明に増加していた。以上の結果から、腸内細菌叢の変化が自己免疫性膵炎の発症を促進する一つの要因であることが明らかになった。
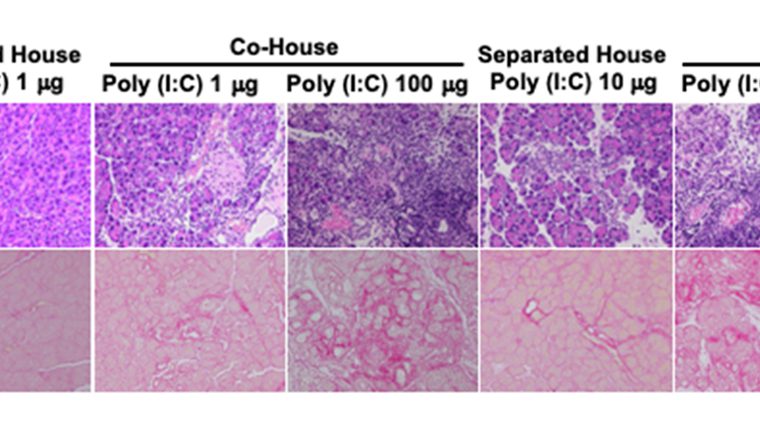
・図の説明詳細:MRL/MpJマウスにPoly(I:C)(合成二本鎖RNA、ウイルス由来の二本鎖RNAと同等の免疫賦活作用を有する)を繰り返し、投与することにより、自己免疫性膵炎を誘導することができる。
自己免疫性膵炎の発症には通常Poly(I:C)100µgの投与を要するが、自己免疫性膵炎を発症したマウスの腸内細菌が移行するような条件で飼育すると、Poly(I:C)10µg(通常量の1/10)の投与でも強い自己免疫性膵炎が起こる。
Separated House; 腸内細菌の移行が生じない条件での飼育
Co-House; 腸内細菌の移行が生じる条件での飼育
5. 用語解説
※1 形質細胞様樹状細胞
免疫細胞の一つ。I型IFNを産生することに特化した樹状細胞
※2 I型インターフェロン
細胞から分泌されるタンパク質であるサイトカインの一種。微生物感染、特にウイルス感染の場合に多く産生され、微生物感染の際の免疫防御に重要な役割を果たしている。その一方で、非感染時に多く産生されると、免疫疾患を引き起こす。
※3 インターロイキン33
細胞から分泌されるタンパク質であるサイトカインの一種。炎症、アレルギー、組織が異常増殖する現象である線維化に重要な役割を果たす。
6. 今後の展望
本研究により、自己免疫性疾患の発症に、腸内細菌叢の変化が大きく関わることが明らかになった。「腸内細菌叢・I型インターフェロン・インターロイキン33」の制御を用いた自己免疫性膵炎の新規治療法の開発が期待される。
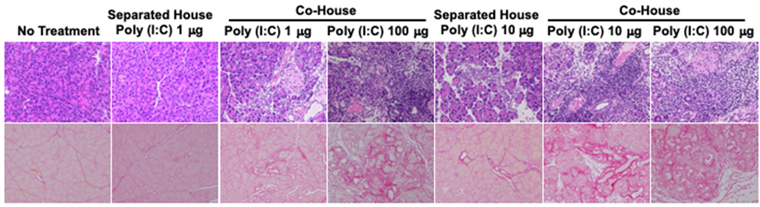
腸内細菌の移行による自己免疫性膵炎の発症促進作用